1998 LS 8.1 Metallbindung einfache sprache
Metalle, Halbmetalle und Nichtmetalle
80 % aller Elemente im Periodensystem der Elemente (PSE) sind Metalle. Metalle sind Elemente mit metallischen Eigenschaften (hohe elektrische und thermische Leitfähigkeit, Glanz, Härte, Duktilität und die Fähigkeit zur Bildung metallischer Bindungen). Metalle stehen links im PSE (Ausnahme H Wasserstoff).
Rechts im PSE stehen die Nichtmetalle. Die Nichtmetalle haben nicht die metallischen Eigenschaften (einzelne metallische Eigenschaften können vorkommen).
Zwischen den Metallen und Nichtmetallen gibt es Halbmetalle. Die Halbmetalle haben Eigenschaten zwischen den Metallen und Nichtmetallen. Sie sind z.B. nicht so gute elektrische Leiter wie Metalle aber auch nicht so schlechte elektrische Leiter wie Nichtmetalle.
Verbindung von Atomen
Atome, also die kleinsten Bausteine von allem, haben so etwas wie kleine "Schalen", in denen Elektronen (kleine Teilchen) sind. Am glücklichsten sind Atome, wenn sie in ihrer letzten Schale genau 8 Elektronen haben.
Metalle: Sie haben nur wenige Elektronen in ihrer äußersten Schale. Es ist einfacher für sie, diese wenigen Elektronen abzugeben als viele dazuzunehmen. Daher geben Metalle ihre Elektronen oft ab. Die Elektronen in der äußersten Schale nennen wir Valenzelektronen.
Wenn Atome sich miteinander verbinden, können verschiedene "Bindungen" entstehen:
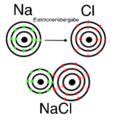
1. Metallatom + Nichtmetallatom = Ionenbindung: Hier gibt das Metall seine Elektronen an das Nichtmetall ab. Bei dieser Verbindung sind keine Elektronen frei. Beispiele dafür sind:
- Korund (Al2O3): Hier verbindet sich Aluminium (Metall) mit Sauerstoff (Nichtmetall).
- Kochsalz (NaCl): Natrium (Metall) verbindet sich mit Chlor (Nichtmetall).
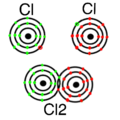
2. Nichtmetallatom + Nichtmetallatom = Atombindung: Bei dieser Verbindung teilen sich die beiden Nichtmetalle ihre Elektronen. Das bedeutet, sie "leihen" einander Elektronen. Beispiele dafür sind:
- Wasser (H2O): Hier teilen sich Wasserstoff und Sauerstoff ihre Elektronen.
- Methan (CH4): Hier teilen sich Kohlenstoff und Wasserstoff ihre Elektronen.
- Auch viele Kunststoffe haben diese Art von Bindung.
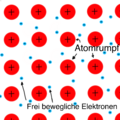
3. Metallatom + Metallatom = Metallbindung: Hier teilen sich Metallatome ihre Elektronen, die dann zwischen den Atomen hin und her bewegen können. Dadurch bekommen Metalle ihre besonderen Eigenschaften, wie zum Beispiel, dass sie Strom leiten können. Alle Metalle haben diese Art von Bindung.
Metallbindung
Kristalliner Aufbau
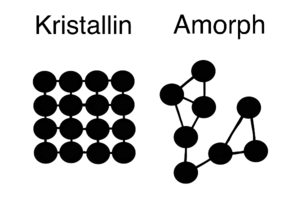
Metalle verbinden sich oft so, dass ihre Atome in einer regelmäßigen, immer wiederkehrenden Reihenfolge angeordnet sind. Wenn Atome so geordnet sind, nennt man das kristallin. Metalle sind oft in dieser kristallinen Form.
Wenn Atome nicht in einer regelmäßigen Reihenfolge angeordnet sind, ist das das Gegenteil von kristallin und wird amorph genannt. In amorphen Stoffen sind die Atome nicht gleichmäßig angeordnet.
Regelmäßige Anordnung durch Anziehung und Abstoßung
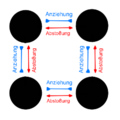
Metalle haben Atome, die sich in einer bestimmten, regelmäßigen Weise anordnen. Man kann sich das so vorstellen: Jedes Metallatom hat eine positive Ladung im Atomkern (+) und ist von negativen Elektronen im Elektronengas (-) umgeben.
Diese positiven Metallatomkerne (+) ziehen die negativen Elektronen im Elektronengas (-) an, aber gleichzeitig stoßen sich die positiven Metallatome (+ und +) untereinander ab. Je näher sie sich kommen, desto stärker stoßen sie sich ab.
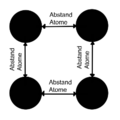
Es gibt also zwei Arten von Kräften: Anziehende Kräfte zwischen den positiven Atomkernen und den negativen Elektronen, und abstoßende Kräfte zwischen den positiven Atomen untereinander. Diese Kräfte finden ein Gleichgewicht, und das bestimmt, wie weit die Atome voneinander entfernt sind. An diesem Punkt sind die Anziehungs- und Abstoßungskräfte genau gleich stark. Das ist der Abstand zwischen den Atomen in Metallen.
Die positiven Metallatomkerne im Elektronengas nennen wir auch Metallionen.
Übung
H5P Übung
Lernender des ADBK-Düsseldorf? Dann finden Sie die interaktive Übung in Moodle.
Nachfolgend die Sprinterinhalte