Radikalische Polymerisation Level 3/4
Chemische Grundlagen der radikalischen Polymerisation (Level 3/4)
Auf Level 3/4 solltest du in der Lage sein, die Texte, Lernvideos und Übungen in Eigenregie zu bearbeiten und die notwendigen Fachkompetenzen zu erwerben! Traust du dir das nicht zu, dann wechsle in den Level 1/2. Dort hilft dir deine Lehrkraft!
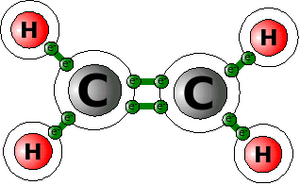
Methacrylsäuremethylester ist ein kompliziertes Molekül: Um zu lernen, wie sich die MMA-Moleküle verbinden, sind nur die beiden Kohlenstoff-Atome in der Mitte des Moleküls von Bedeutung (alles andere nennen wir ab jetzt als "Rest").
Aber was genau ist ein "Kohlenstoff-Atom"?
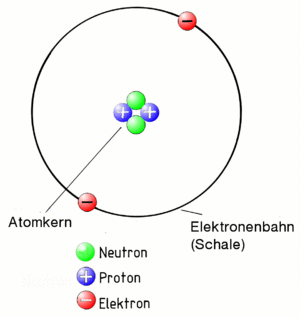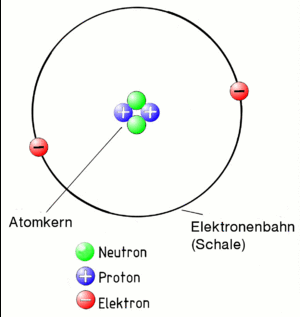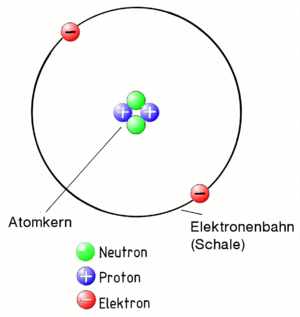
Das Bohrsche Atommodell
Zuerst der Begriff Atom:
Ein Atom besteht aus einen positiv geladenen Kern und den negativ geladenen Elektronen, die den Kern auf Bahnen (auch Schalen genannt) umkreisen. Weil der Kern positiv geladen ist und die Elektronen negativ, ziehen sie sich an. Deshalb fliegen die Elektronen nicht aus der Bahn. Das gesamte Gebilde "Atom" muss aber insgesamt eine neutrale Ladung haben. Daher muss der Kern genau so viele positiv geladenen Teilchen enthalten (sogenannte Protonen), wie negative, die als Elektronen um ihn herum fliegen!
Damit die eng gepackten Protonen im Kern sich nicht gegenseitig abstoßen, sind im Kern noch sogenannte Neutronen, die - wie der Name schon sagt - neutral also gar nicht geladen sind. Sie halten die Protonen ein wenig auf Abstand.
Übrigens, das alles entspricht dem Atommodell nach Niels Bohr, der sich das vor fast 100 Jahren so überlegt hat. Es ist nicht ganz korrekt, reicht uns aber um alles das zu erklären, was wir wissen müssen.
Lernvideo zum Bohrschen Atommodell:
Nun zum Begriff Kohlenstoff:
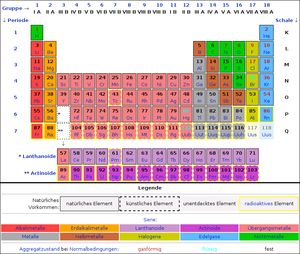
Atome unterscheiden sich in der Anzahl ihrer Protonen und Elektronen (es müssen ja, wie oben erwähnt, immer gleich viele sein). Je nach Anzahl der Protonen hat jede Atomsorte einen anderen Namen. Es gibt Wasserstoff (1 Proton), Helium (2 Protonen), Lithium (3 Protonen) usw. Kohlenstoff ist das Element mit 6 Protonen. Es gibt zur Zeit 116 dieser Atomsorten, man nennt sie Elemente. Damit die Wissenschaftler, aber auch du, nicht den Überblick verlieren, haben schlaue Leute sie im "Periodensystem der Elemente" (kurz PSE) sortiert.
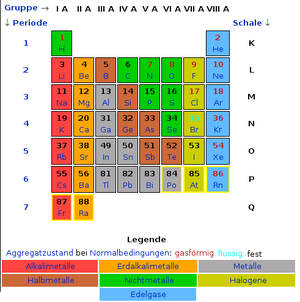
Das Periodensystem der Elemente
Das Periodensystem ist eigentlich eine Tabelle mit Zeilen und Spalten. Die Spalten heißen "Gruppen", wobei uns erstmal nur die acht Hauptgruppen interessieren (IA, IIA, .... , VIIIA). Die sogenannten Nebengruppen (IB, IIB, ..., VIIIB) werden wir später in der Ausbildung im Lernfeld "Metalle" näher betrachten.
Die Zeilen heißen Perioden (manchmal auch Schalen, da sie die Bahnen der Elektronen um den Atomkern widerspiegeln). Sie sind notwendig, da jede Bahn (oder Schale) nur eine begrenzte Anzahl von Elektronen verkraften kann. (Je größer sie werden, desto mehr). Hier findest du das Periodensystem zum Ausdrucken.
Die Elemente sind von links nach rechts mit einer so genannten Ordnungszahl durchnummeriert. Diese Zahl entspricht wieder der Anzahl der Protonen (und natürlich der Elektronen). Die erste Periode (die K-Schale) kann max. 2, die zweite (die L-Schale) max. 8, die dritte (M-Schale) max. 18 usw. Elektronen aufnehmen. Die Formel für die max. Anzahl der Elektronen lautet 2 x n², wobei n für die Nummer der Schale steht. Die max. Elektronen-Anzahl der zweiten Periode errechnet sich also aus 2 x 2² = 8. In den Hauptgruppen haben aber alle Elemente max. 8 Elektronen auf der äußersten Schale. Sie heißen Valenzelektronen und bestimmen die Eigenschaften der Elemente (Metall - Nichtmetall z.B.). Bei diesem System kommt es so aus, dass alle Elemente einer Hauptgruppe gleich viele Elektronen auf der äußeren Schale haben (Außenelektronen). Das verleiht ihnen auch jeweils ähnliche chemisch Eigenschaften.
Das Periodensystem interaktiv:
Lernvideo zum Periodensystem der Elemente:
Übung: Baue mit dem [Molekülbaukasten|Blender-Molekülbaukasten] die Atome nach, aus denen das Methylmethacrylat-Molekül besteht! Mache Bildschirmfotos und gib die Bilder in der Lernlandkarte in Deinem Lernmanagementsystem ab.
Edelgaskonfiguration
Wie kommen Atome verschiedener (oder auch gleicher) Elemente nun auf die Idee, sich miteinander zu verbinden?
Da sie alle neutral geladen sind (also gleich viele Elektronen und Protonen besitzen) müssten sie eigentlich mit sich und der Welt zufrieden sein! Sind sie aber fast alle nicht! Sie sind von einem allen gemeinsamen Wunsch beseelt: Sie wollen unbedingt 8 Elektronen auf der äußersten Schale haben. Zur Erfüllung dieses Wunsches tun sie fast alles! Ausgenommen davon sind die Elemente in der achten Hauptgruppe, sie haben nämlich schon 8 Elektronen auf der äußeren Schale, man nennt das Edelgaskonfiguration. Sie heißen auch Edelgase (Helium, Neon, Argon, Krypton, Xenon und Radon mit Namen) und verbinden sich mit Nichts und Niemandem. Die Ausnahme (die es scheinbar immer geben muss ;-)) von der 8er-Regel ist Helium, es hat ja nur zwei Elektronen auf der äußeren Schale. Da dies die erste Schale ist, die ja nur zwei aufnehmen kann, ist Helium damit ebenfalls hochzufrieden.
Die anderen Elemente müssen also etwas unternehmen, um entweder an zusätzliche Elektronen zu kommen und so die äußere Schale auf 8 Elektronen aufzufüllen oder die auf der äußersten Schale abzugeben, damit die volle Schale darunter dann zur äußeren wird.
Bindungsarten
1. Verbindungsmöglichkeit: Elektronenabgabe bzw. -aufnahme. Am Beispiel des Kochsalzes (bestehend aus Natrium und Chlor) ist das ganz einfach erklärt. Natrium steht in der ersten Hauptgruppe, hat also ein Elektron auf der äußersten (dritten) Schale. Chlor ist in der siebten aufgelistet, hat also sieben Außenelektronen. Gibt Natrium ein Elektron an Chlor ab, ist die äußere Schale leer, dann wird bei ihm die zweite (mit 8 Elektronen voll besetzte) Schale zur äußersten. Chlor dagegen nimmt diese Elektron auf und füllt damit seine äußerste Schale auf 8 Elektronen auf.
Als Folge dieses "Elektronenaustauschs" stimmt aber die Anzahl der Elektronen und Protonen in den beiden Atomen nicht mehr. Natrium hat ein Elektron zu wenig (ist also jetzt positv geladen), während Chlor eins zu viel hat und damit negativ geladen ist. Solche geladenen Atome nennt man Ionen (positiv oder negativ geladene Atome). Bekanntlich ziehen sich ungleiche Ladungen an. Daher sind diese beiden unterschiedlich geladenen Ionen nun bis an ihr Ende miteinander verbunden und kommen so einfach nicht mehr voneinander los. Sie bilden ein Kochsalz-Molekül.
Diese Bindungsart bezeichnet man als Ionenbindung. Sie funktioniert nur zwischen Elementen mit jeweils wenig und vielen Außenelektronen. Genauer nur zwischen Metallen und Nichtmetallen.
2. Verbindungemöglichkeit: Gemeinsame Nutzung von Elektronen.
Jetzt nähern wir uns langsam der Ausgangfrage: Wie schaffen es die Kohlenstoff-Atome des MMA sich zu verbinden?
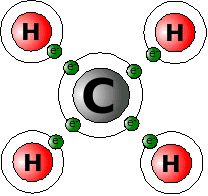
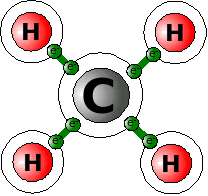
Nehmen wir dazu als Beispiel ein ganz einfaches Molekül, das CH4 (Methan). Zeichnen wir uns die Struktur der Elemente mit den Außenelektronen mal auf.
C (Kohlenstoff) hat 4 Außenelektronen, Wasserstoff je eins. Kohlenstoff fehlen also 4, jedem Wasserstoff ein Elektron. Also entschließen sich die 5 Atome, ihre Elektronen gemeinsam zu nutzen. Das Kohlenstoffatom benutzt jedes Elektron der 4 Wasserstoffatome mit, also stehen ihm jetzt 8 Elektronen zur Verfügung, Edelgaskonfiguration! Jedes Wasserstoffatom darf ein Elektron der vier äußeren Kohlenstoffelektronen mitbenutzen. Jedes Wasserstoffatom hat also jetzt 2 Elektronen zur Verfügung, Edelgaskonfiguration!
So sind alle beteiligten Atome zufrieden, aber über die gemeinsame Elektronennutzung aneinander gebunden. Diese Art der Bindung nennt man Kovalente Bindung, Atom-Bindung oder Elektronenpaarbindung. Der letzte Name zeigt, dass man sich jeweils zwei gegenseitig zur Verfügung gestellte Elektronen als Elektronenpaar vorstellen kann.
3. Verbindungsmöglichkeit: Die Metallbindung. Sie ist hier nicht von Bedeutung und wird erst im dritten Ausbildungsjahr Thema.
Überprüfe dein neues Wissen mit dieser interaktive Übung zu den chemischen Grundlagen der Polymerisation. Als Schülerin oder Schüler des ADBK Düsseldorf bearbeitest du diese Übung bitte unbedingt in deinem Klassen-Moodle-Kurs!
Die Polymerisation
Die Kohlenwasserstoffe
Es gibt viele verschiedene Möglichkeiten, Kohlenstoff und Wasserstoffatome miteinander zu koppeln. Dabei kommt die Anzahl der zur Verfügung stehenden Außenelektronen zum Austausch nicht immer gut aus.
Prima funktioniert das bei den gesättigten Kohlenwasserstoffen (sogennante Alkane):
CH4 Methan
C2H6 Ethan
C3H8 Propan
C4H10 Butan
Weniger gut passt es bei ungesättigten Kohlenwasserstoffen (z.B. die Alkene):
C2H4 Ethen
C3H6 Propen
C4H8 Buten
Die ungesättigten Kohlenwasserstoffe benutzen einen Trick, da sie nicht genug Wasserstoffatome zur gemeinsamen Nutzung von Elektronen zur Verfügung haben. Es verwenden einfach die Kohlenstoffatome untereinander ihre Elektronen gemeinsam. Beim Ethen zum Beispiel ist das wie rechts abgebildet gelöst.
Skizziere zur Übung einmal die Strukturformel von Propen (du musst bestimmt ein wenig tüfteln ;-)).
Lernvideo zu den Kohlenwasserstoffen:
Diese sogenannte Doppelbindung macht diese Moleküle allerdings ein wenig instabil (ungesättigt eben). Sie würden gern ihre Doppelbindung in eine einfache umwandeln. Damit sind wir am Ausgangspunkt unserer Überlegungen angekommen:
Wie schaffen es die einzelnen Moleküle aber nun, so lange flüssig zu bleiben, bis wir sie verarbeiten wollen und wie schaffen sie es, ausgerechnet dann fest zu werden?
Die Doppelbindung hilft dabei!
Unser MMA-Molekül können wir dazu bringen, seine Doppelbindung zu öffnen, man sagt das Molekül wird radikal!
Ein solches radikales Molekül animiert ein anderes MMA-Molekül ebenfalls dazu radikal zu werden usw. Jetzt hängt aber rechts und links am Molekül ein offenes Elektron. Da jedes radikale Molekül aber jetzt zwei solche einsamen Elektronen hat, können diese sich zur gemeinsamen Nutzung zusammentun. Damit ist eine Kettenbildung ausgelöst.
Kettenbildung und Gesundheitsgefahren
Diese Kettenbildung, die Reaktion von ungesättigten Verbindungen zu Makromolekülen, nennt man Polymerisation.
Die Polymerisation soll natürlich nicht automatisch zu irgendeinem Zeitpunkt ablaufen sondern erst dann, wenn wir den Individuellen Abformlöffel soweit fertig haben, dass er hart werden soll.
Deshalb sind dem Monomer Moleküle zugemischt, die radikale Moleküle einfangen und sie blockieren. Gäbe es sie nicht, würde die Monomerflüssigkeit im Laufe der Zeit von selbst hart werden und wäre nicht lagerfähig. Solche Stoffe nennt man Inhibitoren (lat. inhibere = verhindern).
Gleichzeitig sind dem Monomer Moleküle beigemischt, die die Kettenbildung (Polymerisation) gezielt auslösen. Das sind Moleküle, die "auf Befehl" radikal werden und so den Beginn einer Kette darstellen, die dann rasant schnell von allein immer länger wird. Diese Moleküle heißen Initiatoren (sie initiieren sozusagen die Kettenbildung). Initiatoren reagieren entweder auf UV-Licht (Lichthärtender Kunststoff) oder auf ein Partnermolekül im Pulver, mit dem das Monomer vermischt wird (Autopolymerisat). Initiatoren haben als erstes Molekül in der Kette nur ein freies Elektron!
Übrigens, das Pulver ist nichts anderes als schon fertig polymerisiertes Monomer, dass in ganz kleinen Kügelchen vorliegt.
Eine Polymerisation läuft daher in drei Phasen ab.
- Kettenstart (Startreaktion): Ein Initiator wird durch UV-Licht oder ein Partnermolekül aus dem Pulver radikalisiert und bildet das Startmolekül einer Molekülkette. Die weiteren Moleküle radikalisieren sich gegenseitig.
- Kettenwachstum (Wachstumsreaktion): Die weitere gegenseitige Radikalisierung hält das Wachstum der Kette in Gang. Läßt man diese Reaktion ungestört (Achtung Herstellerangaben zur Polymeristaionszeit unbedingt einhalten) ablaufen, bilden sich lange vernetzte Ketten und es bleibt wenig Restmonomer (nicht in Ketten eingebaute Monomer-Moleküle) übrig.
- Kettenabbruch (Abbruchreaktion): Es gibt mehrere Möglichkeiten die Reaktion zu beenden:
- Fast alle Monomermoleküle sind verbraucht, die Polymerisation ist fertig. Es bleiben allerdings immer ein paar restliche Monomermoleküle übrig, die noch kein Kettenende gefunden haben. Ist dieser Restmonomergehalt zu hoch, kann auch der fertige Kunststoff ähnlich schädlich wie das Monomer sein.
- Ein radikaler Initiator mit nur einem freien Elektron gelangt an das Ende einer Kette. Da das zweite Elektron fehlt, geht's an dieser Stelle nicht weiter, für diese Kette ist das Wachstum beendet.
- Ein Inhibitor setzt sich an ein Kettenende und blockiert das weitere Wachstum. Dummerweise funktioniert Sauerstoff (der in der Luft ja auch vorhanden ist) als Inhibitor für die Initiatoren des UV-Lichthärtenden-Kunststoffs. Somit wird die Kettenbildung an der Oberfläche der Kunststoffplatten durch Sauerstoff blockiert, eine nicht polymerisierte Schicht aus Monomer-Polymer-Gemisch bleibt zurück. Sie wird Inhibitionsschicht genannt.
Nun weißt du, wie Kunststoff hart wird. Er polymerisiert in langen Molekülketten. Die Gesamtheit aller Atombindungen, die im Polymer vorkommen, nennt man Primaärbindungen. Da sich die Ketten der vielen einzelnen Polymerisationsreaktionen auch physikalisch miteinander verknoten, spricht man hierbei von der Sekundärbindung.
Gesundheitlich problematisch ist dieser polymerisierte Kunststoff nur, wenn man ihn bearbeitet und dabei kleine Späne entstehen. Man kann über diese Späne in Kontakt mit Restmonomer kommen. Umso gefährlicher ist das noch nicht polymerisierte Monomer-Molekül. Den Kontakt mit diesen Molekülen (auch über die Atemluft, du kannst Monomer riechen) musst du unbedingt vermeiden. Hautausschläge, Allergien, Übelkeit und viele weitreichende Gesundheitsschädigungen können die Folge des Kontaktes sein. Deshalb gibt es eine verpflichtende Betriebsanweisung der Berufsgenossenschaft zum Umgang mit Methylmethacrylat im Labor, die dich vor diesem Zeug schützen soll! Folgende Gefahrenkennzeichnungen gelten für Methacrylsäuremethylester (H- und P-Sätze):
- H: 225‐315‐317‐335
- P: 210‐233‐280‐302+352‐304+340‐403+235
Mehr darüber erfährst du im weiteren Verlauf des Unterrichts im Artikel Arbeits-_und_Gesundheitsschutz.
Lernvideo zur radikalischen Polymerisation:
Überprüfe dein neues Wissen mit dieser interaktive Übung zur radikalischen Polymerisation. Als Schülerin oder Schüler des ADBK Düsseldorf bearbeitest du diese Übung bitte unbedingt in deinem Klassen-Moodle-Kurs!
Auf Level 3/4 hast du noch ein paar weitere Aufgaben zu erledigen!
Zuerst diese hier:
Baue das Makromolekül des Methacrylsäuremethylesters und eine Molekülkette mit 5 Makromolekülen dem Blender Molekülbaukasten nach! Fertige dir Bildschirmfotos deiner Arbeit an und erläutere sie schriftlich. Baue noch an passender Stelle ein Initiatormolekül (Benzoylperoxid) ein.
Zuletzt noch diese Aufgabe:
Du sollst nun zum Thema Benzoylperoxid deinen Forschergeist trainieren! Benzyolperoxid wird in lichthärtendem Kunststoff als Photoinitiator verwendet. Wie funktioniert das?